旭光通商株式会社 取締役
山西 幸男
紫外線を含む太陽光にさらされたときに、化粧品や医薬部外品に含まれる成分が肌に思わぬ影響を与えることがあります。これが「光毒性」や「光アレルギー」と呼ばれる反応です。本記事では、これらの現象の違い、発症の仕組み、安全性試験の方法について、専門用語をわかりやすく解説します。

紫外線(UV)や可視光線が皮膚に与える影響は古くから知られており、特に化粧品や医薬部外品に含まれる成分が光に反応することで、皮膚に有害な反応を引き起こす「光毒性」が問題視されています。近年では、製品の国際展開や規制強化に伴い、光毒性評価の重要性が一層高まっています。本記事では、最新の評価ガイドラインに基づき、化粧品・医薬部外品における光毒性の基本と試験法について解説します。
この記事の監修

旭光通商株式会社 取締役
山西 幸男
紫外線を含む太陽光にさらされたときに、化粧品や医薬部外品に含まれる成分が肌に思わぬ影響を与えることがあります。これが「光毒性」や「光アレルギー」と呼ばれる反応です。本記事では、これらの現象の違い、発症の仕組み、安全性試験の方法について、専門用語をわかりやすく解説します。

光毒性(Phototoxicity)は、特定の化学物質が紫外線(特にUVA)を吸収することで、活性酸素などの有害物質を生成し、皮膚に赤みや腫れなどの炎症反応を引き起こす現象です。日焼けに似た症状ですが、原因は光と化学物質の相互作用にあります。
光アレルギー(Photoallergy)は、紫外線によって変化した化学物質が、体内の免疫システムに「異物」として認識され、アレルギー反応を引き起こす現象です。繰り返しの曝露が原因となることが多く、発症までに時間がかかります。
| 分類 | 光毒性 | 光アレルギー |
|---|---|---|
| 発症条件 | 1回の曝露で発症 | 繰り返しの接触で発症 |
| 反応の種類 | 刺激性反応(アレルギーではない) | 免疫系を介したアレルギー反応 |
| 症状の発現時間 | 短時間(数時間以内) | 遅延性(1〜3日後に発症) |
| 主な症状 | 赤み、腫れ、熱感 | 湿疹、かゆみ、発疹など |
医薬品や化粧品は肌に直接使用されるため、安全性は非常に重要です。特に紫外線にさらされる場面が多いため、製品成分が光毒性や光アレルギーを引き起こさないことを事前に確認する必要があります。
以下では、代表的な光安全性評価の各ステップと、それに対応する試験法を図とともに解説します。
ステップ1:光吸収性の確認(MEC)
まず、対象物質が紫外線領域(290〜700nm)で光を吸収するかどうかを確認します。MECが1000未満であれば、次のステップに進む必要はありません。

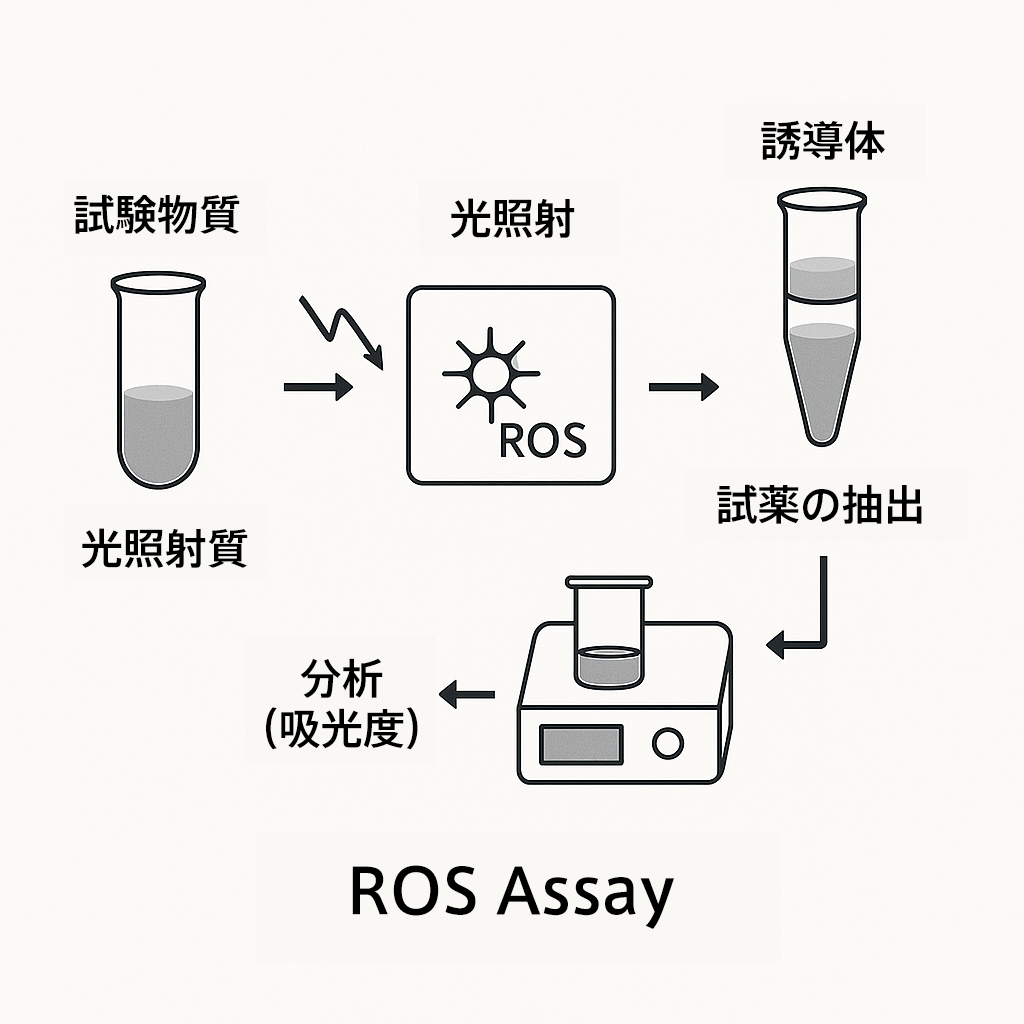
ステップ2:光反応性試験(ROSアッセイ)
MECで光吸収が確認された場合、次にROSアッセイにより光励起による活性酸素生成の有無を確認します。TG495に準拠した試験法です。
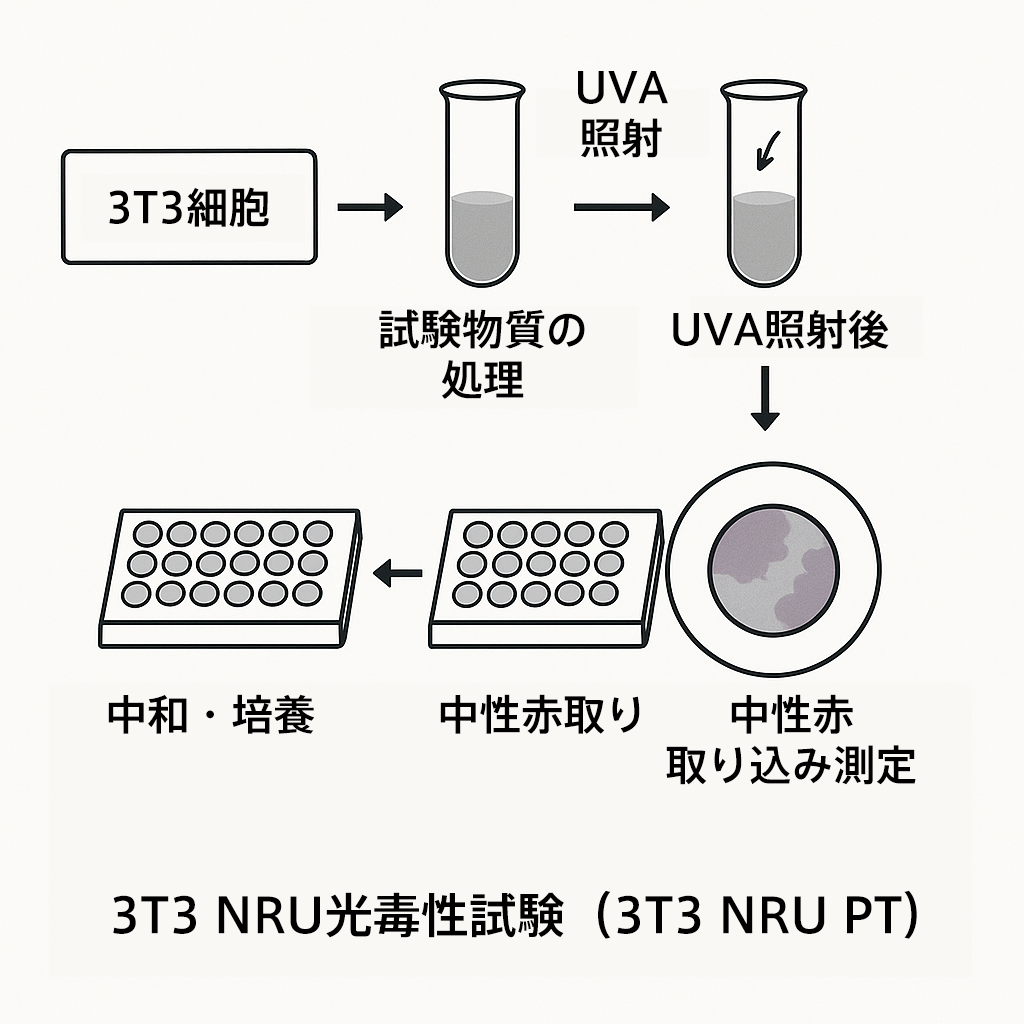
ステップ3:光毒性試験(3T3 NRU PT)
ROSアッセイで陽性となった場合は、最終的に細胞毒性を確認するために3T3 NRU PTを実施します。OECD TG432に準拠した試験です。
物質が290〜700nmの波長で光を吸収するかを確認します。モル吸光係数(MEC)が1000 L mol-1 cm-1未満であれば、光毒性の懸念は小さいとされます。
活性酸素の生成を評価するin chemico試験。OECD TG495として国際的に認められており、スクリーニングに適しています。
マウス線維芽細胞を用いたin vitro試験で、OECD TG432に準拠。2019年に改訂され、試験条件や判定基準に一部更新がありました。
現時点で確立された代替法はなく、in vivo試験が主に用いられています。
光毒性や光アレルギーは、身近な製品によって起こりうるリスクです。製品開発においては、国際ガイドラインに則った適切な評価を実施することが、安全性の担保と消費者信頼につながります。
最短7日間で校正完了光安全性の測定のご相談はこちら